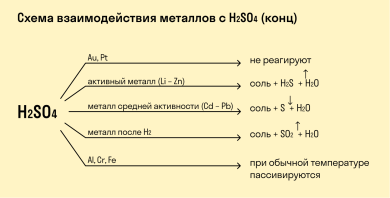
Как определить, какое вещество легче вступает в реакцию с металлом?
Чтобы понять, какое вещество вступит в реакцию с металлом легче, нужно разобраться в химических свойствах веществ и их способности к взаимодействию с металлами.
Определение химической активности металла
Химическая активность металла — это его способность вступать в химические реакции с другими веществами. Чем выше активность металла, тем легче он будет реагировать с другими веществами, в т.ч. с неметаллами, кислотами и солями.
В первую очередь, активность металла определяется его положением в электрохимическом ряду напряжений металлов; Чем левее находится металл в этом ряду, тем он активнее. Например, калий (K) является более активным металлом, чем медь (Cu), так как он находится левее в ряду напряжений.
Активность металла также зависит от его физического состояния (твердое, жидкое, газообразное), температуры и присутствия катализатора. Например, медь в порошкообразном состоянии будет реагировать с кислородом воздуха гораздо быстрее, чем в виде слитков.
Важно отметить, что активность металла не является абсолютным показателем. Она зависит от условий реакции. Например, золото (Au) — один из самых инертных металлов, но в присутствии царской водки (смесь концентрированных азотной и соляной кислот) оно растворяется.
Следовательно, для определения активности металла необходимо учитывать не только его положение в ряду напряжений, но и конкретные условия реакции.
Изучение электрохимического ряда напряжений металлов
Электрохимический ряд напряжений металлов — это упорядоченный список металлов, расположенных в порядке возрастания их стандартных электродных потенциалов. Стандартный электродный потенциал — это мера склонности металла отдавать электроны и переходить в ионное состояние. Чем более отрицательным является стандартный электродный потенциал металла, тем легче он отдаёт электроны и тем активнее он является.
В электрохимическом ряду напряжений металлов левее расположены более активные металлы, а правее — менее активные. Например, литий (Li) — самый активный металл, а золото (Au) — один из самых инертных.
Этот ряд позволяет предсказывать направление и возможность протекания реакций между металлами и другими веществами. Например, если металл находится левее водорода в ряду напряжений, то он будет реагировать с кислотами с выделением водорода. А если металл находится правее водорода, то он не будет реагировать с кислотами.
Изучение электрохимического ряда напряжений металлов, это важный инструмент для понимания химических свойств металлов и предсказания их поведения в различных реакциях.
Сравнение потенциалов металлов
Чтобы определить, какое вещество легче вступает в реакцию с металлом, необходимо сравнить стандартные электродные потенциалы металла и вещества. Стандартный электродный потенциал (Е°) — это величина, характеризующая склонность металла отдавать электроны и переходить в ионное состояние. Чем более отрицательным является стандартный электродный потенциал металла, тем легче он отдает электроны и тем активнее он является.
Например, если вы хотите сравнить реакционную способность цинка (Zn) и меди (Cu), нужно посмотреть их стандартные электродные потенциалы. Стандартный электродный потенциал цинка равен -0,76 В, а меди +0,34 В. Это значит, что цинк более активный металл, чем медь, так как он легче отдает электроны.
Сравнивая потенциалы металла и вещества, можно определить, будет ли протекать реакция между ними. Если потенциал металла более отрицательный, чем потенциал вещества, то реакция будет протекать, и металл будет окисляться.
Например, если поместить медную пластинку в раствор нитрата серебра (AgNO3), то начнется реакция, так как потенциал меди (+0,34 В) более отрицательный, чем потенциал серебра (+0,80 В). В результате реакции на медной пластинке образуется осадок серебра, а в растворе образуется нитрат меди (Cu(NO3)2).
Таким образом, сравнение потенциалов металлов позволяет предсказать направление и возможность протекания реакции между металлами и другими веществами.
Анализ химических свойств веществ
Помимо сравнения стандартных электродных потенциалов, важно учесть и химические свойства веществ, которые могут вступать в реакцию с металлом. Разные вещества обладают разной химической активностью, то есть способностью вступать в реакции с другими веществами.
Например, кислоты, такие как соляная кислота (HCl) или серная кислота (H2SO4), активно реагируют с металлами, особенно с активными, такими как цинк (Zn), железо (Fe) или магний (Mg). В результате реакции выделяется водород (H2) и образуются соли.
С другой стороны, некоторые вещества, такие как вода (H2O), могут реагировать с металлами только при определенных условиях, например, при повышенной температуре или в присутствии кислорода. Например, магний (Mg) и кальций (Ca) реагируют с водой, выделяя водород и образуя гидроксиды.
Некоторые вещества, такие как галогены (фтор (F2), хлор (Cl2), бром (Br2), йод (I2)), могут активно реагировать с металлами, образуя соли. Например, железо (Fe) реагирует с хлором (Cl2), образуя хлорид железа (FeCl3).
Важно понимать, что реакционная способность вещества зависит не только от его химических свойств, но и от условий реакции, таких как температура, давление, концентрация реагентов.
Таким образом, анализ химических свойств веществ позволяет предсказать, будет ли протекать реакция между металлом и веществом, а также какие продукты реакции могут образоваться.
Проведение практических экспериментов
Чтобы окончательно убедиться, какое из веществ легче вступает в реакцию с металлом, можно провести ряд простых практических экспериментов. Важно помнить о правилах техники безопасности при работе с химическими веществами и проводить эксперименты под наблюдением опытного человека.
Например, можно взять два одинаковых образца металла, например, цинка (Zn), и поместить их в разные растворы⁚ в один раствор соляной кислоты (HCl), а в другой ⏤ раствор уксусной кислоты (CH3COOH). Наблюдайте за реакцией, которая будет протекать в каждом из растворов.
В растворе соляной кислоты реакция будет протекать более активно, чем в растворе уксусной кислоты. Это связано с тем, что соляная кислота является более сильной кислотой, чем уксусная. Вы заметите, что в растворе соляной кислоты выделяется больше пузырьков газа (водорода), а сам цинк растворяется быстрее.
Можно также провести эксперимент с растворами разных концентраций одного и того же вещества. Например, взять два раствора соляной кислоты (HCl)⁚ один разбавленный, а другой концентрированный. Поместите в каждый раствор по образцу цинка (Zn) и наблюдайте за реакцией.
В концентрированном растворе соляной кислоты реакция будет протекать более активно, чем в разбавленном. Это связано с тем, что концентрация ионов водорода (H+) в концентрированном растворе выше, что приводит к более быстрому протеканию реакции.
Проведение практических экспериментов позволяет наглядно увидеть, как разные вещества реагируют с металлом, и оценить их относительную активность. Это поможет вам лучше понять химические свойства веществ и их способность к взаимодействию с металлами.